MONALEESA-3
MONALEESA-3-studiet sammenlignede effekten af første- og andenlinje-behandling med Kisqali(ribociclib) og fulvestrant vs. placebo og fulvestrant hos postmenopausale patienter med ER-positiv og HER2-normal metastatisk brystkræft. Studiet påviste en signifikant overlevelsesfordel for patienter, der fik Kisqali, og påviste den hidtil længste samlede overlevelse for patienter med metastatisk brystkræft i førstelinjebehandling i et klinisk fase III-studie1.
Metoder
Studiedesign
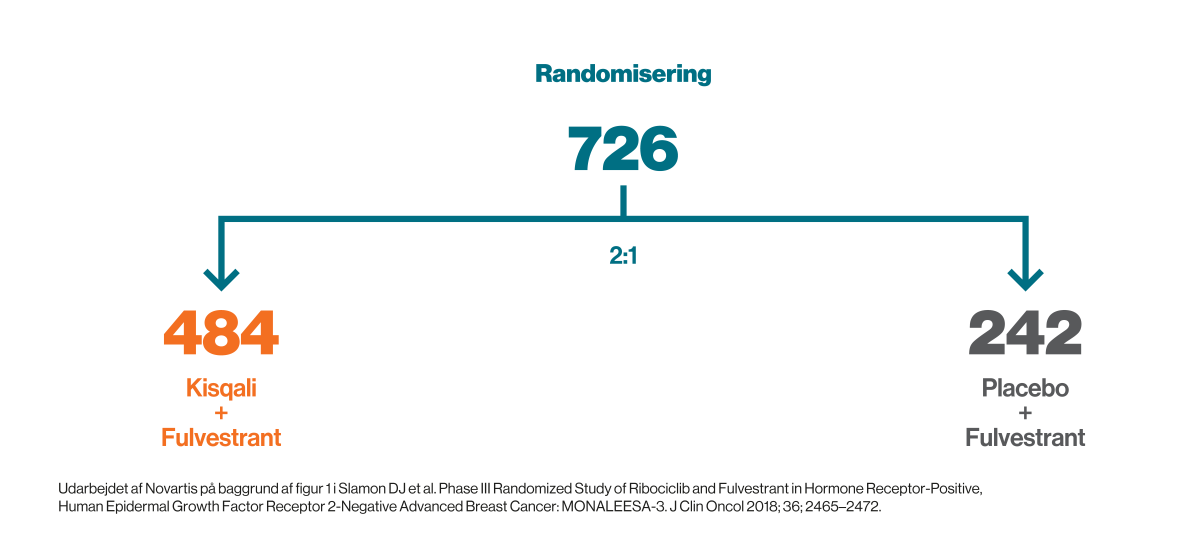
MONALEESA-3 var et internationalt dobbeltblindet, placebokontrolleret fase III-studie. Patienterne blev randomiseret i ratioen 2:1 til at få Kisqali og fulvestrant eller placebo og fulvestrant.
- Det primære endepunkt var progressionsfri overlevelse (PFS).
- Sekundære endepunkter inkluderede samlet overlevelse (OS), samlet responsrate, klinisk fordel og sikkerhed2.
De inkluderede patienter var postmenopausale kvinder med ER-positiv og HER2-normal metastatisk brystkræft.
Studiet inkluderede to overordnede subgrupper:
Patienter, der fik behandling i første linje, inkluderede patienter med de novo metastatisk brystkræft og patienter, der havde haft tilbagefald mere end 12 mdr. efter afsluttet (neo)adjuvant endokrin behandling, som ikke før havde fået behandling for avanceret/ metastatisk sygdom.
Patienter, der fik behandling i anden linje, inkluderede:
- patienter der havde haft tilbagefald mindre end eller 12 mdr. efter afsluttet (neo)adjuvant endokrin behandling, som ikke tidligere var behandlet for metastatisk sygdom.
- patienter der havde tilbagefald mere end 12 mdr. efter afsluttet (neo)adjuvant endokrin behandling, som havde progression efter en linje endokrin behandling for metastatisk sygdom.
- patienter der havde metastatisk sygdom ved diagnosetidspunktet, havde haft progression efter en linje endokrin behandling, og som ikke tidligere havde fået (neo)adjuvant behandling for tidlig brystkræft.2
Inklusionskriterier: Patienter måtte ikke have modtaget kemoterapi mod metastatisk sygdom eller tidligere behandling med fulvestrant eller en CDK4/6-hæmmer3.
Patienterne skulle have mindst én målbar læsion i henhold til RECIST v.1.1 eller mindst én overvejende lytisk læsion og have en ECOG Performance Status ≤1.
Patienter måtte ikke have inflammatorisk brystkræft, symptomatisk visceral sygdom eller anden sygdomsbyrde, der indikerede, at de ikke var kvalificeret til endokrin behandling. De måtte heller ikke have hjertearytmier, der var klinisk signifikante, eller ukontrolleret hjertesygdom, herunder QTcF > 450 ms2.
Randomisering: Randomiseringen blev stratificeret i henhold til tilstedeværelse/fravær af lever eller lungemetastaser og tidligere endokrin behandling.
484 patienter blev randomiseret til at få Kisqali (600 mg oralt om dagen i tre uger, efterfuldt af en én uge uden) og fulvestrant (500 mg intramuskulært på dag 1 i hver cyklus på 28 dage samt endnu en dosis på dag 15 i den første cyklus). 242 patienter blev randomiseret til at få placebo og fulvestrant2.
Crossover imellem grupperne var ikke tilladt2.
Analyse MONALEESA-3-studiets resultater er blevet publiceret fire gange – efter en median opfølgningstid på hhv. 20,4 mdr., 39,4 mdr., 56,3 mdr. og 70,8 mdr.2,3,4,1.
Patient-karakteristik2
Baseline karakteristik var velbalanceret mellem de to grupper. Patienterne i Kisqali-gruppen havde en medianalder på 63 år. 46,7 % var 65 år eller ældre, og 13,8 % af disse var 75 år eller ældre.
Størstedelen var kaukasere (85,3 %), asiater (8,7 %) eller sorte (0,7 %).
Tidligere behandlinger:
- Adjuverende kemoterapi: 42,7 %
- Neoadjuverende kemoterapi: 13,1 %
- Adjuverende endokrin behandling: 58,5 %
- Neoadjuverende endokrin behandling: 1,4 %
Sygdom:
- De novo metastatisk sygdom: 19,1 %
- Knoglesygdom alene: 21,2 %
- Visceral sygdom: 60,5 %5
Resultater
Samlet overlevelse
OS for patienter, der fik Kisqali og fulvestrant i første linje: Kisqali forlængede den samlede overlevelse (OS) signifikant med 15,8 mdr. sammenlignet med placebo1
Overlevelsesraten ved 5 år blev estimeret til at være 56,5 % for Kisqaligruppen (95 % CI: 49,5-62.9 %) og 42,1 % for placebogruppen (95 % CI: 33,2–50,7 %)1.
OS for patienter, der fik Kisqali og fulvestrant i anden linje: Kisqali forlængede den samlede overlevelse (OS) med 6 mdr. sammenlignet med placebo1
For patienter, der fik behandlingen i anden linje, var den estimerede median OS ved den seneste analyse: 39,7 mdr. i Kisqali-gruppen og 33,7 mdr. i placebo-gruppen, HR: 0,80 (95 % CI: 0,61-1,05).
Overlevelsesraten ved 5 år for patienter, der fik andenlinje-behandling blev estimeret til at være 34,9 % for Kisqaligruppen (95 % CI: 28,6-41.4 %) og 25,7 % for placebogruppen (95 % CI: 17,7-34,4 %).
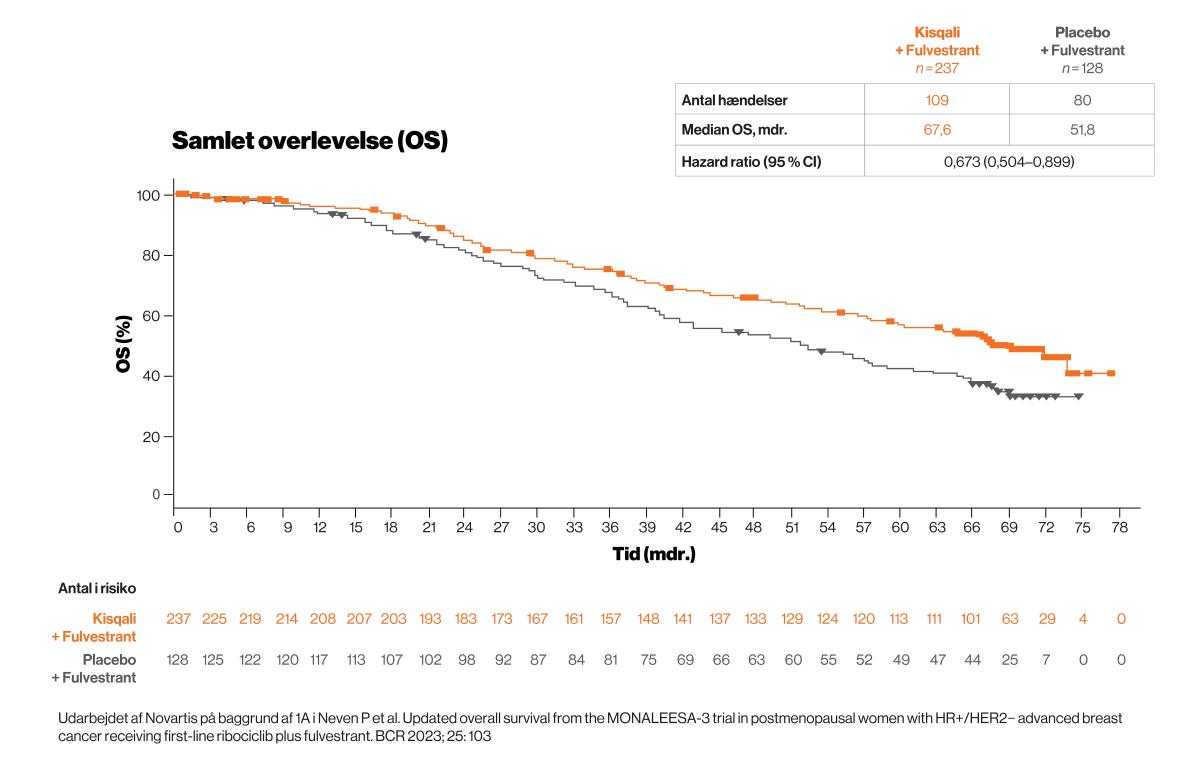
OS for alle inkluderede patienter: Kisqali gav en signifikant overlevelsesfordel og forlængede den samlede overlevelse (OS) med 10,7 mdr1 sammenlignet med placebo.
Efter 70,8 måneder, var den estimerede median OS: 52,2 mdr. i Kisqali-gruppen, mens den var 41,5 mdr. i placebo-gruppen, HR: 0,75 (95 % CI: 0,62-0,92).
Overlevelsesraten efter 5 år blev estimeret til 45,6 % for Kisqaligruppen (95 % CI: 40,8-50,2 %) og 35,0 % for placebogruppen (95 % CI: 28,8-41.2 %).
Progressionsfri overlevelse
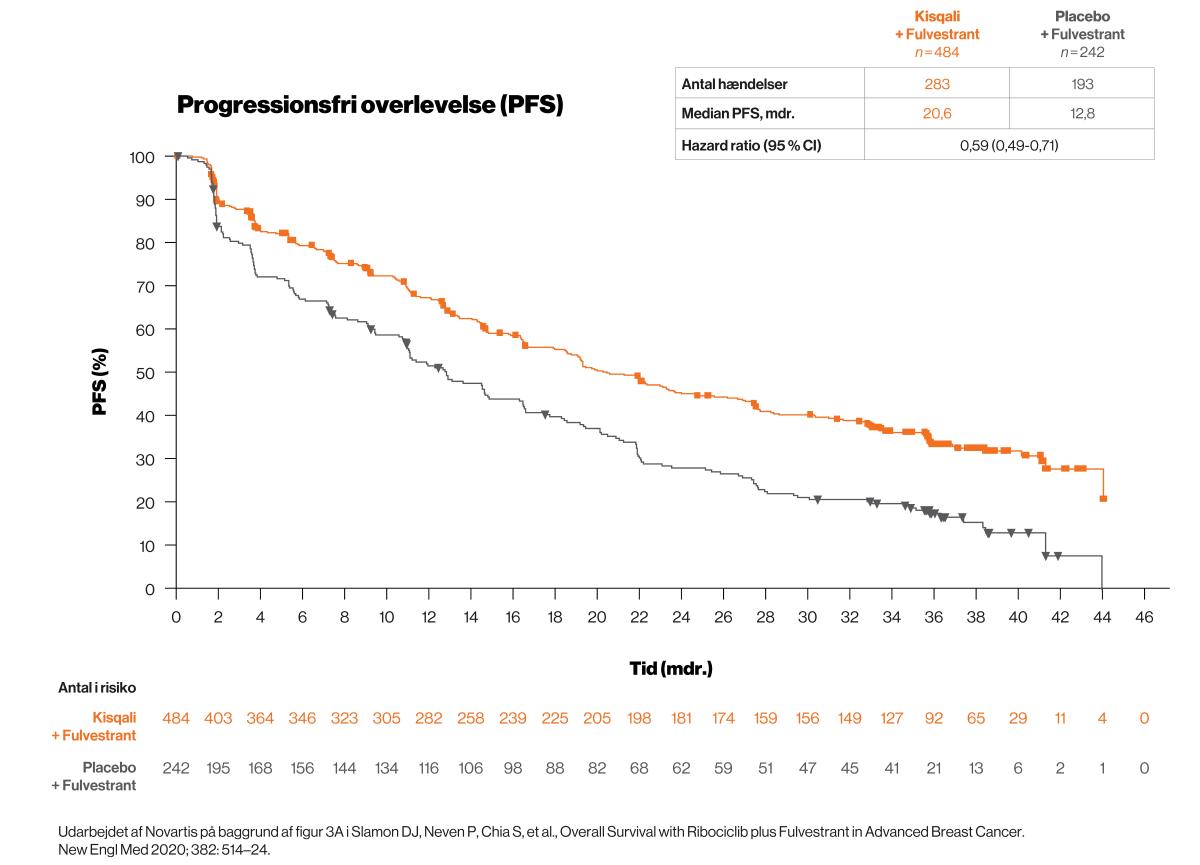
PFS for den samlede population: Kisqali forlængede den progressionsfri overlevelse med 7,8 mdr.3
PFS for patienter, der fik førstelinje-behandling: Kisqali forlængede den progressionsfri overlevelse med 14,4 mdr.3
For de patienter, der fik behandling i første linje, var median PFS:
- 33,6 mdr. i Kisqali-gruppen (95 % CI: 27,1; 41,3)
- 19,2 mdr. i placebo-gruppen (95 % CI: 14,9; 23,6)
- HR: 0,55 (95 % CI: 0,42; 0,72)
PFS for patienter, der modtog behandling i anden linje: Kisqali forlængede den progressionsfri overlevelse med 5,5 mdr. sammenlignet med placebo3
For patienter, der modtog behandlingen i anden linje, var median PFS:
- 14,6 mdr. for Kisqali og fulvestrant
- 9,1 mdr. for placebo og fulvestrant
- HR: 0,57 (95 % CI: 0,44; 0,74)3
PFS2
For patienter, der fik behandling i første linje, blev den progressionsfri overlevelse på næste linje behandling eller død (PFS2) også estimeret. I den seneste analyse var PFS2 16,1 mdr. længere i Kisqali-gruppen end i placebogruppen (HR: 0,64; 95 % CI: 0,49-0,84).
Kemoterapi-fri overlevelse
For patienter, der fik behandling i første linje, var medianen for kemoterapi-fri overlevelse 20,2 mdr. længere i Kisqali-gruppen, sammenlignet med placebo-gruppen (HR: 0,62; 95 % CI: 0,48-0,81). Der var desuden en relativ reduktion i risikoen for kemoterapi på 43 %1 i Kisqali-gruppen sammenlignet med placebo-gruppen.
Samlet responsrate og klinisk fordel
Samlet responsrate (ORR) i Kisqali-guppen var 32,4 % (95 % CI: 28,3-36,6 %) og 21,5 % i placebo-gruppen (95 % CI: 16,3-26,7 %).
Samlet responsrate for patienter med målbar sygdom var 40,9 % i Kisqali-gruppen (95 % CI: 35,9-45,8 %) og 28,7 % i placebo-gruppen (95 % CI: 22,1-35,3 %).
Raten for klinisk fordel (CBR) var 70,2 % i Kisqali-gruppen (95 % CI: 66,2-74,3 %) og 62,8 % i placebo-gruppen (56,7-68,9 %).
Raten for klinisk fordel hos patienter med målbar sygdom var hhv. 69,4 % i Kisqali-gruppen (95 % CI: 64,8-74,0) og 59,7 i placebo-gruppen (95 % CI: 52,5-66,8)5.
Bivirkninger
I den første analyse blev følgende bivirkninger af grad 3 rapporteret hos ≥ 10 % af patienterne:
- Neutropeni: 46,6 % i Kisqali-gruppen og 0 % i placebogruppen.
- Leukopeni: 13,5 % i Kisqali-gruppen og 0 % i placebogruppen.
Den eneste bivirkning af grad 4, der blev observeret i ≥ 5 % af patienterne, var neutropeni: 6,8 % i Kisqali-gruppen og 0 % i placebogruppen2.
Ved de tre senere opfølgninger var der ikke nyt at tilføje til sikkerhedsprofilen. For patienter, der fik behandlingen i første linje, var neutropeni fortsat den mest almindelige bivirkning af grad 3 eller 4 (60,3 % i Kisqali-gruppen og 1,6 % i placebo-gruppen)1 ved den seneste analyse (median opfølgningstid 70,8 mdr.)1.
Konklusion
MONALEESA-3-studiet påviste en signifikant højere samlet overlevelse for patienter, der fik Kisqali og fulvestrant sammenlignet med patienter, der fik placebo og fulvestrant. Den seneste analyse havde en opfølgningstid på 70,8 mdr. og påviste en mediantid for den samlede overlevelse på 67,6 mdr. for Kisqali-gruppen – den længste overlevelse, der på udgivelsestidspunktet var rapporteret for patienter med metastatisk brystkræft i førstelinjebehandling i et klinisk fase-III studie1.
Kilder
-
Neven P, Fasching PA, Chia S et al. Updated overall survival from the MONALEESA-3 trial in postmenopausal women with HR+/HER2− advanced breast cancer receiving first-line ribociclib plus fulvestrant. BCR 2023; 25: 103.
-
Slamon DJ, Neven P, Chia S, et al. Phase III Randomized Study of Ribociclib and Fulvestrant in Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: MONALEESA-3. J Clin Oncol 2018, 36, 2465–2472.
-
Slamon DJ, Neven P, Chia S, et al., Overall Survival with Ribociclib plus Fulvestrant in Advanced Breast Cancer. New Engl Med 2020; 382: 514–24.
-
Slamon DJ, Neven P, Chia S et al. Ribociclib plus fulvestrant for postmenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer in the phase III randomized MONALEESA-3 trial: updated overall survival. Ann Oncol 2021; 32: 1015-1024.
-
KISQALI® produktresumé

