MONALEESA-2 [1]
MONALEESA-2
MONALEESA-2-studiet sammenlignede effekten af førstelinjebehandling med Kisqali (ribociclib) og letrozol med placebo og letrozol hos postmenopausale patienter med ER-positiv og HER2-normal metastatisk brystkræft. Studiet viste, at både den samlede overlevelse (OS) og den progressionsfri overlevelse (PFS) var signifikant længere for patienter, der fik Kisqali og letrozol sammenlignet med placebo og letrozol1,2,3.
Metoder
Studiedesign
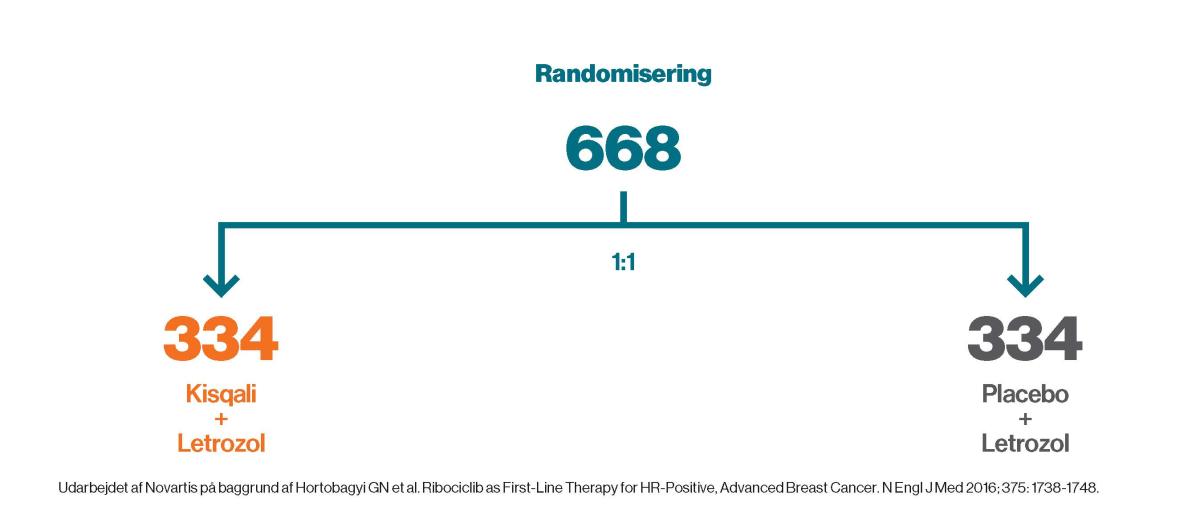
MONALEESA-2 var et randomiseret, dobbeltblindet, placebokontrolleret, fase III multicenter-studie, der sammenlignede førstelinje-behandling med Kisqali og letrozol vs. placebo og letrozol.
- Det primære endepunkt var lokalt vurderet progressionsfri overlevelse (PFS) i henhold til RECIST v1.1.
- Det vigtigste sekundære endepunkt var samlet overlevelse (OS).
Inklusionskriterier: De inkluderede patienter var postmenopausale kvinder med ER-positiv, HER2-normal metastatisk brystkræft, som ikke tidligere havde modtaget systemisk behandling for metastatisk sygdom.
Patienterne havde målbar sygdom i henhold til RECIST v.1.1 eller mindst én overvejende lytisk læsion og en ECOG-Performancestatus ≤1.
Forudgående (neo)adjuverende endokrin behandling var tilladt. Forudgående (neo)adjuverende behandling med non-steroide aromatasehæmmere var kun tilladt, hvis det var mere end 12 måneder siden, patienten havde fået sidste dosis.
Patienter blev ikke inkluderet, hvis de havde inflammatorisk brystkræft, aktiv hjertesygdom, tidligere hjertesygdom eller hjerterytmeforstyrrelser, inklusiv et QTcF længere end 450 ms.
Randomisering: Randomiseringen blev stratificeret i henhold til tilstedeværelse/fravær af lever- eller lunge-metastaser1,3.
334 patienter blev randomiseret til at få Kisqali (600 mg ribociclib oralt én gang dagligt i 21 på hinanden følgende dage, efterfulgt af 7 dage uden, så en fuld cyklus varede 28 dage). 334 patienter blev randomiseret til at få placebo. Patienter i begge grupper fik letrozol 2,5 mg dagligt og kontinuerligt.
Dosisreduktion af Kisqali var tilladt for Kisqali (fra 600 mg til 400 mg til 200 mg om dagen) for at håndtere behandlingsrelaterede bivirkninger. Dosisreduktion af letrozol var ikke tilladt.
Patienter, der afbrød behandlingen med Kisqali eller placebo, var tilladt at fortsætte med letrozol. Crossover imellem grupperne var ikke tilladt2.
Analyse: MONALEESA-2-studiets resultater er blevet publiceret efter en median opfølgningstid på 15,3; 26,4 og 80 mdr3,2,1.
Patient-karakteristik
Baseline karakteristik var velbalanceret mellen de to grupper. Patienterne i Kisqali-gruppen havde en medianalder på 62 år (interval: 23 til 91). 44,2 % af patienterne var 65 år eller ældre, herunder 69 ældre end 75 år4.
De inkluderede patienter var kaukasiere (82,2 %), asiater (7,6 %) og sorte (2,5 %).
Tidligere behandling i Kisqali-gruppen1:
- Tidligere neoadjuverende eller adjuverende kemoterapi: 46,6 %
- Tidligere neoadjuverende eller adjuverende antihormonbehandling: 51,3 %
Sygdom i Kisqali-gruppen:
- De novo: 34,1 %
- Knoglesygdom alene: 22,0 %
- Visceral sygdom: 58,8 %4
Resultater
Samlet overlevelse
OS-analysen viste, at der var en signifikant overlevelsesgevinst for patienter, der fik Kisqali1.
OS for den samlede population:
Patienter, der fik Kisqali, havde en overlevelsesfordel på 12,5 måneder1
Den endelige analyse viste en signifikant og klinisk relevant fordel for Kisqali med en overlevelsesfordel på 12,5 måneder, når man sammenlignede Kisqali-gruppen med placebo-gruppen.
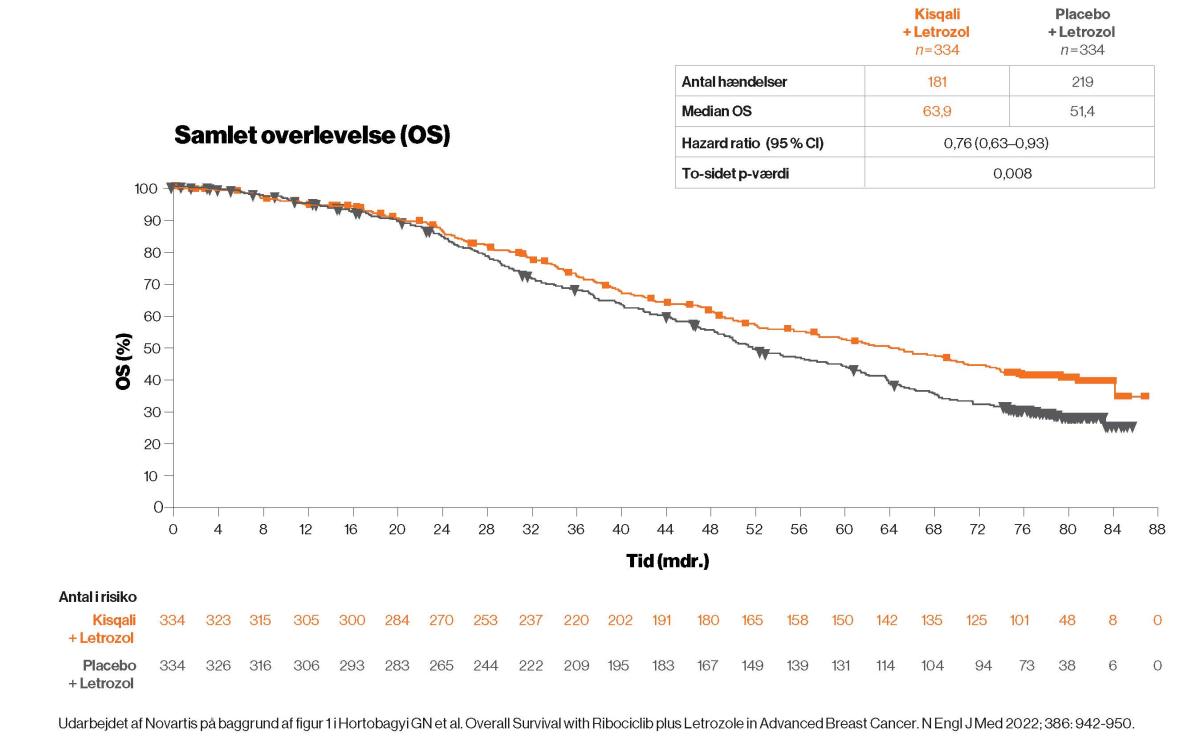
Overlevelsesfordelen indtrådte efter cirka 20 måneder og fortsatte med at stige med længere opfølgningstider1. Den endelige analyse blev foretaget, da 400 dødsfald var indtruffet.
Effekten af Kisqali blev endnu mere udtalt, når resultaterne blev reguleret for efterfølgende behandling med CDK4/6-hæmmere hos placebogruppen – analysen regulerede median OS i placebo-gruppen til at blive 50,5 mdr. (95 %CI: 45,0-55,4) i stedet for 51,4 mdr. (95 % CI: 47,2-59,7) (HR: 0,73; 95 % CI: 0,58-0,92). Det understreger fordelen ved Kisqali som første-linjebehandling til patienter med metastatisk brystkræft yderligere1.
Der blev også foretaget en eksplorativ analyse af OS i subgrupper, der adskilte sig i patient- og sygdomskarakteristik, geografi, tidligere behandlinger og metastasers placering. Her var resultaterne for OS konsistente med resultaterne for den samlede population, dog var nogle subgrupper små, hvilket resulterede i brede konfidensintervaller.
Progressionsfri overlevelse
Kisqali gav en signifikant længere progressionfri overlevelse og demonstrerede en fordel på 9,3 mdr. sammenlignet med placebo
To analyser af PFS blev gennemført, før OS-data blev analyseret. Begge viste en signifikant fordel i Kisqali-gruppen sammenlignet med placebo-gruppen2,3. Den seneste analyse havde en median opfølgningstid på 26,4 mdr. og viste, at den mediane progressionsfri overlevelse var 9,3 mdr. længere i Kisqali-gruppen end i placebo-gruppen2.
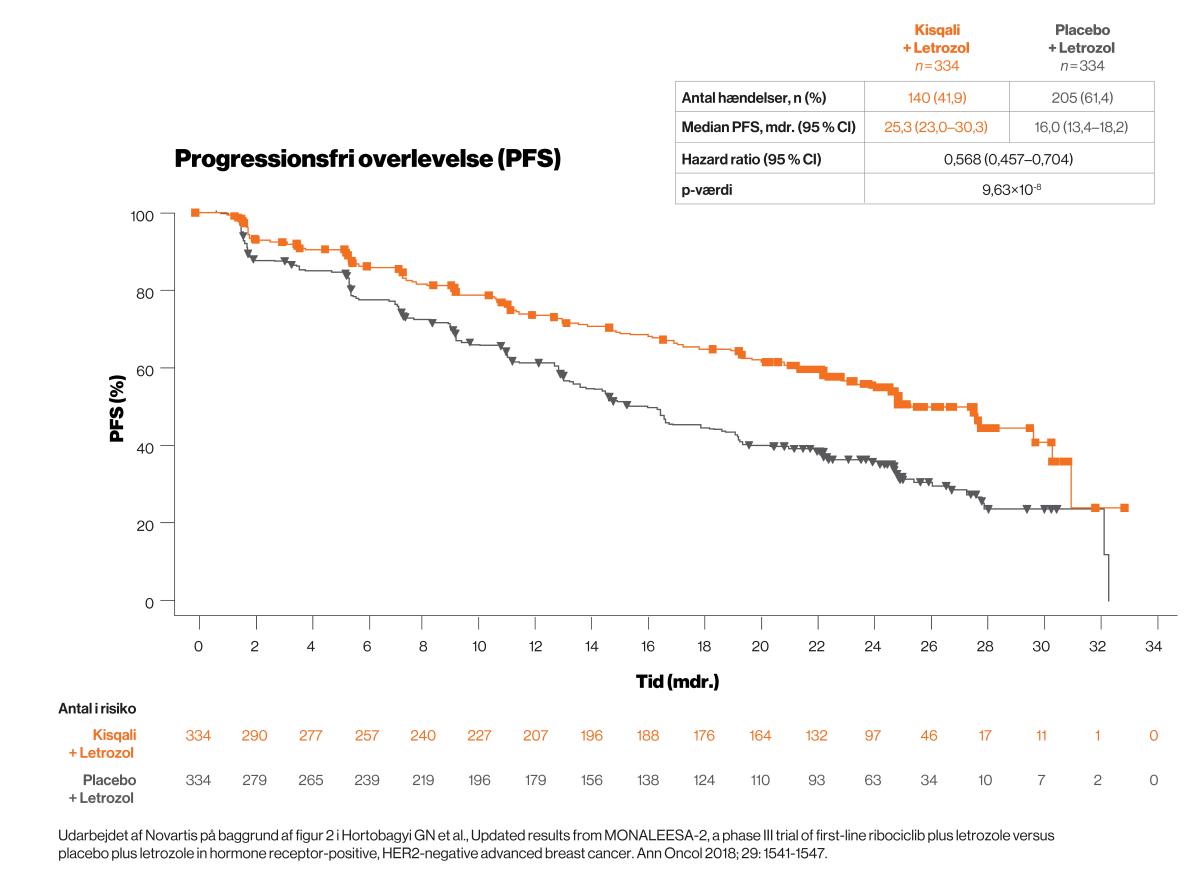
Denne anden interim-analyse viste fortsat en længere progressionsfri overlevelse for Kisqali-gruppen, sammenlignet med placebo-gruppen uafhængigt af:
- PIK3CA- og TP53-mutationsstatus
- Samlet Rb, Ki67 eller p16 protein-ekspression
- mRNA-niveauer for CDKN2A, CCND1 eller ESR1
Fordelen ved Kisqali var mere udtalt hos patienter med wild type-sygdom end hos patienter, der havde forandringer i receptor tyrosinkinase (RTK)-generne2.
Kemoterapi-fri overlevelse
I alt afbrød 179 patienter (28 %) behandlingen og fik kemoterapi (alene eller i kombination) som den første efterfølgende behandling. Mediantiden til første efterfølgende kemoterapi var 50,6 mdr. i Kisqali-gruppen, sammenlignet med 38,9 mdr. i placebo-gruppen (HR: 0,74; 95 % CI: 0,61-0,91).
I alt fik 229 patienter (68,6 %) i Kisqali-gruppen enten kemoterapi eller døde inden, mens tallet for placebo-gruppen var 258 (77,2 %). Medianen for kemoterapi-fri overlevelse var 39,9 mdr. i Kisqali-gruppen og 30,1 mdr. i placebo-gruppen (HR: 0,74: 95 % CI: 0,62-0,89)1.
Samlet responsrate
Den samlede responsrate, observeret ved den anden interim-analyse, var:
- For Kisqali gruppen: 42,5 %
- For placebo-gruppen: 28,7 %
(P = 9,2,54 x 10-5)
Blandt patienter med målbar sygdom ved baseline var værdierne:
- For Kisqali-gruppen: 54,5 %
- For placebo-gruppen: 38,8 %
(P = 2,54 x 10-4)
Efter otte uger blev tumorstørrelsen evalueret første gang, og her sås tumorreduktion hos 76 % i Kisqali-gruppen og 67 % i placebo-gruppen – en forskel, der fortsat sås ved den anden interim-analyses skæringsdato cirka et år senere2.
Klinisk fordel
Den kliniske fordel blev ved den første interim-analyse rapporteret til at være:
- 79,6 % i Kisqali-gruppen
- 72,8 % i placebo-gruppen
(P = 0,02)
Blandt patienter med målbar sygdom var tallene:
- 80,1 % i Kisqali-gruppen
- 71,8 % i placebo-gruppen
(P = 0,02)
Bivirkninger
Ved den første interim-analyse blev der rapporteret følgende almindelige bivirkninger af grad 3 eller 4 hos mere end 10 %:
- Neutropeni (59,3 % i Kisqali-gruppen vs. 0,9 % i placebo-gruppen)
- Leukopeni (21,0 % i Kisqali-gruppen vs. 0,6 % i placebo-gruppen).
I Kisqali-gruppen afbrød 7,5 % af patienterne behandlingen pga. bivirkninger, mens tallet for placebo-gruppen var 2,1 %3.
Resultaterne fra de opfølgende analyser var i overensstemmelse med resultaterne fra den første analyse. Den seneste analyse havde en median opfølgningstid på 80 mdr., og her blev der ikke observeret nogle nye sikkerhedssignaler. De mest almindelige og interessante bivirkninger af grad 3 eller 4 var på det tidspunkt:
- Neutropeni (63,8 % i Kisqali-gruppen vs. 1,2 % i placebo-gruppen)
- Toksisk effekt på det hepatobiliære system (14,4 % i Kisqali-gruppen vs. 4,8 % i placebo-gruppen)
- Forlænget QT-interval (4,5 % i Kisqali-gruppen vs. 2,1 % i placebo-gruppen)1
Bivirkninger opstod typisk tidligt og kunne håndteres med monitorering og afbrydelse eller reduktion af dosis2.
Konklusion
Den samlede overlevelse var signifikant længere i Kisqali-gruppen end i placebo-gruppen. Den mediane samlede overlevelse var mere end 12 måneder længere i Kisqali-gruppen sammenlignet med placebo-gruppen1. Den progressionsfri overlevelse (PFS) var 9,3 måneder længere i Kisqali-gruppen end den var i placebo-gruppen2.
Kilder
-
Hortobagyi, GN, Stemmer SM, Burris HA et al. Overall Survival with Ribociclib plus Letrozole in Advanced Breast Cancer. N Engl J Med 2022; 386: 942-950.
-
Hortobagyi GN, Stemmer SM, Burris HA et al., Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol 2018; 29: 1541-1547.
-
Hortobagyi, GN, Stemmer SM, Burris HA et al. Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med 2016; 375: 1738-1748.
-
KISQALI® produktresumé